|
作者 李敏1a,2 ,陈超阳1a,许俊羽1a,马凌悦1a,康子胜1b,李欣然1a,2 ,赵侠1a,周颖1a,崔一民1a ( 1. 北京大学 第一医院,a. 药剂科; b. 临床药 理研究所,北京 100034; 2. 北京大学 药学院 药事管理与临床药学系,北京 100191) 来源中国临床药理学杂志 第34卷 第3期2018年2月( 总第 257 期)316-318 摘要目的 建立高效液相色谱法测定人血浆中伏立康唑浓度的方法学。 方法 色谱柱: ZORBAX Eclipse Plus C18,柱温: 40 ℃,流速: 1 mL·min-1,流动相: 甲醇 - 水 = 55∶ 45,检测波长: 254 nm,内标: 对氯苯乙酰胺。考察该方法的专属性、标准曲线与定量下限、精密度与回收率、稳定性。 结果 血浆中内源性杂质对样品测定无干扰,血浆中伏立康唑在 0. 1 ~ 10. 0 μg·mL-1内线性良好( r = 0. 999 2) ,最低检测浓度为 0. 1 μg·mL -1。血浆中伏立康唑日内、日间RSD 均 < 10% ,提取回收率为 89% ~ 92% 。 结论 本方法简便、灵敏、准确、高效,适用于人体内伏立康唑的浓度监测。 关键词伏立康唑; 代谢物; 高效液相色谱法; 血浆 中图分类号R978. 1 文献标志码A 文章编号1001 - 6821( 2018) 03 - 0316 - 03 DOI10. 13699 /j. cnki. 1001 - 6821. 2018. 03. 038
伏立康唑( VRC) 是第 1 个临床有效的第Ⅱ代三唑类广谱抗真菌药,对曲霉菌、假丝酵母菌、新型隐球菌和一些不常见的霉菌均有效[1],尤其对侵袭性曲霉菌浸润干扰疗效很好。伏立康唑可以口服或静脉注射,在口服后 2 h 可迅速吸收,生物利用度超过 90% 。成人体内伏立康唑的消除呈非线性药代动力学,儿童体内消除呈线性,需要高剂量才能达到成人的血药浓度[2]。伏立康唑主要经肝细胞色素P450( CYP450) 酶系代谢,很大程度受到 CYP2C19 基因型的影响[3]。CYP2C19 具有基因多态性,且在种族间有显著差异。因此,建议进行伏立康唑的临床治疗药物监测,以便及时调整给药方案,实现个体化用药。本文建立一种简便、灵敏、准确、高效的 HPLC 方法,用于人血浆中伏立康唑的浓度测定,实现伏立康唑的治疗药物监测。 材料与方法 1 药品与仪器伏立康唑,纯度: 100% ,批号: 100862 - 201402;氟康唑,纯度: 100% ,批号: 100314 - 201204; 对氯苯乙酰胺,纯度: 100% ,批号: 100850 - 201102,均购自中国食品药品检定研究院。空白健康人血浆样本,北京大学第一医院血库提供。 1100 高效液相色谱系统,美国 Agilent 公司产品;Micro17 台式离心机,美国 Thermo 公司产品。
2 色谱条件色谱柱: ZORBAX Eclipse Plus C18 柱( 4. 6 mm ×250 mm,5 μm) ,流动相: 甲醇 - 水( 55 ∶ 45) ,柱温:40 ℃,流速: 1 mL·min-1,检测波长: 254 nm,进样量:20 μL,内标: 5 μg·mL-1对氯苯乙酰胺。
3 溶液的配制伏立康唑标准品用甲醇配制成相当于1 mg·mL-1伏立康唑储备液,置于 4 ℃保存。临用时,用甲醇稀释成相应的浓度。对氯苯乙酰胺( 内标) 用甲醇配置成相当于 20 μg·mL-1储备液,临用时稀释至 5 μg·mL-1。
4 样品处理方法取血浆标本 200 μL,加入内标对氯苯乙酰胺工作液 20 μL 和伏立康唑标准液 20 μL 于 1. 5 mL 离心管中,震荡混匀。加入甲醇 600 μL 沉淀蛋白,震荡混匀1 min,以 1. 2 × 104r·min-1离心 10 min,吸取上清液20 μL,进样分析。
5 方法学考察专属性 取空白血浆,加入对照品( 伏立康唑、氟康唑和内标对氯苯乙酰胺) 配制的血浆样品,按“样品处理方法”操作并进样测定。 标准曲线与定量下限 取空白血浆 200 μL,加不同量的标准品,使其质量浓度分别为 0. 1,0. 5,1. 0,2. 5,7. 5,10. 0 μg·mL-1。按“样品处理方法”操作,记录样品和内标峰面积,以伏立康唑/对氯苯乙酰胺峰面积比( y) 对伏立康唑浓度( x) 进行线性回归。以S /N≥10,同时满足准确度和精密度要求的标准血浆样品最低浓度为定量下限。 精密度与回收率 配制 0. 3,2. 5,9. 0 μg·mL-1的低、中、高质量浓度的标准品血浆样品,按“样品处理方法”操作,每种浓度平行测定 5 份样本,计算日内和日间的 RSD。另取甲醇 200 μL 作基质分别配制0. 3,2. 5,9. 0 μg·mL-1的低、中、高质量浓度的样品,每种浓度平行测定 5 份样本,计算回收率。 稳定性 配制 0. 3,2. 5,9. 0 μg·mL-1的低、中、高质量浓度的血浆样品,室温放置 24 h、冻融 3 次、- 20 ℃放置 30 d 后,按“样品处理方法”操作,考察其稳定性。 结 果 1 方法学评价专属性 伏立康唑和内标对氯苯乙酰胺的保留时间分别约为 12. 6 和 7. 0 min,血浆样品内源性杂质及氟康唑不干扰伏立康唑的测定。色谱图见图 1。 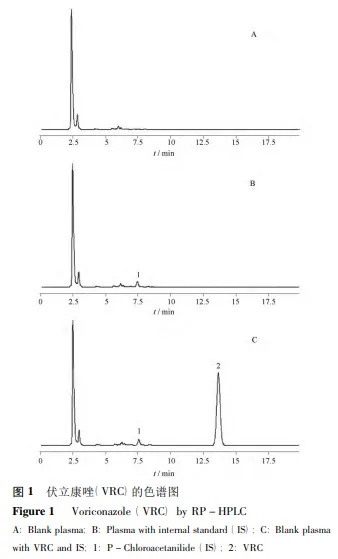 标准曲线与定量下限 伏立康唑在 0. 1 ~ 10. 0μg· mL-1内,线 性 关 系 良 好。标准回归方程为y = 1. 93x + 2. 40 × 10 - 3 ( r = 0. 999 2) ,定量下限为 0. 1μg·mL-1。 精密度与回收率 提取回收率为样品结果与基质样品结果比值,日内,日间 RSD 和回收率,见表 1。 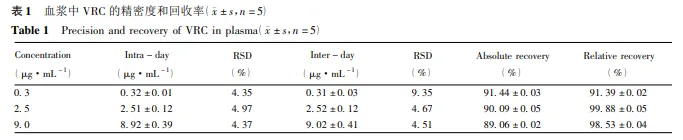 稳定性 血浆样品经室温放置,反复冻融和长期低温保存均稳定,RSD 均< 15% 。 2 方法学验证用本研究建立的方法为 4 例患者进行血药浓度监测,其中 T 细胞母细胞白血病 3 例,急性单核细胞性白血病1例; 男女比例为 1 ∶ 1; 平均年龄为( 37. 25 ± 6. 50) 岁。测得最大血药浓度达 5. 51μg·mL-1,最小为 0. 5 μg·mL-1; 其中在治疗窗内 3例,占 75. 00% ; 高于治疗窗 1 例,占 25. 00% 。 讨 论 目前,关于伏立康唑的有效治疗浓度范围还未有统一 标 准,国外推荐的谷浓度一般为 1. 0 ~ 5. 5μg·mL-1[4]。测定血浆中伏立康唑的方法主要有HPLC 紫外检测法、HPLC 荧光检测法、HPLC-MS法、GC-MS 法[5]和免疫分析测定法[6]等,但国内尚无文献报道。其中,荧光检测法在进行定量分析中,需要排除一些干扰,如背景荧光等。液质法样品处理步骤复杂、仪器昂贵、成本较高,在临床均难推广。本文优化了液相色谱条件,流动相为甲醇-水( 55∶ 45) 。该流动相不含缓冲盐溶液,分析过程中柱压低、分析时间短、分析效率高,有效延长色谱柱寿命,保护色谱系统。同时,伏立康唑和内标的峰形均很好,保留时间分别为 12. 6 和 7. 0 min。有文献通过固相萃取来处理样品,这种方法需要较多不同的溶剂,同时操作复杂,步骤繁琐。本文血浆处理方法采用 3∶ 1 甲醇直接沉淀法,该方法沉淀充分,提取回收率较高,成本较低且简单易行,省去固相萃取、液液萃取等复杂操作。内标选用考虑氟康唑,在确定的色谱条件下,氟康唑的保留时间与伏立康唑相差较大,且峰形偏小。最后选用对氯苯乙酰胺作为内标物质,对氯苯乙酰胺在选定的色谱条件下性质稳定,峰形良好,与伏立康唑能完全分离,保留时间合适且无内源性杂质的干扰。方法学验证结果显示,提取回收率 >85% 。在0. 1~ 10. 0 μg·mL -1内,在相应的生物样品中标准曲线的r > 0. 99,质控样本及稳定性试验符合要求。此方法完全可以满足开展伏立康唑治疗药物监测工作的需求。
|