|
此为药圈会员李整理的药物化学历年真题分析及重点内容总结, 我们可以拿来执业药师考试学习,阅读原文中的重点内容更加突出显示!不考试的同学也可以巩固基础知识。 一、作用于阿片受体的镇痛药 (一)吗啡生物碱 盐酸吗啡 从植物罂粟浆果提取。 结构特点:部分氢化菲环的母核,为由五个稠杂环组成的刚性分子,具有5个手性碳原子 .(C5,C6,C9,C13,C14), 有旋光性。天然存在的吗啡为左旋体。 性质 1)两性化合物(盐酸盐),3位酚羟基,呈弱酸,17位的叔胺呈碱性 2)性质不稳定(3-OH),光照下易氧化变质 碱性、铁离子、日光催化易氧化 酸性条件稳定(pH3~5),抗氧剂(亚硫酸氢钠) 3)酸性脱水并分子重排,生成阿扑吗啡 阿扑吗啡(催吐) 4)吗啡生物碱特有的呈色反应 Marquis反应:甲醛硫酸 紫色 Frōhde 反应:钼硫酸→紫色→兰色、绿色 麻醉药物管理条例管理 (二)半合成镇痛药 吗啡结构改造(3、6、7、8、双键、17位N) 盐酸羟考酮(新) 阿片受体 纯激动剂 可待因的6位羟基氧化成酮,7位双键氢化 镇痛,还可以抗焦虑、止咳和镇静。无极量限制,作用时间长 2.羟基酯化 3.N-烷基化和14-羟基化 盐酸纳络酮 17-烯丙基取代的衍生物 17位N上3~5 个C 取代基,镇痛作用降低,成为阿片受体拮抗剂。 纳络酮是研究吗啡受体的重要工具药物。吗啡过量的解毒剂 4.6,14-亚乙基桥衍生物 (三)合成镇痛药 按化学结构类型主要分为:吗啡喃类、苯吗喃类、哌啶类和氨基酮类。 1.吗啡喃类 吗啡的结构中去掉E环称为吗啡喃。 酒石酸布托啡诺 结构特点:在吗啡结构改造中打开E环,并将双键饱和,醇羟基由6位转移到14位,N上有环丁基甲基取代。 可形成依赖性 镇痛、麻醉辅助 2.苯吗喃类 吗啡喃进一步除去C环称苯吗喃类。 喷他佐辛 是第一个非麻醉性镇痛药。 3.哌啶类 本类药物可看作是吗啡结构仅保留A环和D环的类似物。哌替啶是第一个合成类镇痛药。 盐酸哌替啶 性质: (1)强酸弱碱盐,易溶于水。遇碳酸钠溶液析出游离碱(哌替啶) (2)酯键不易水解:苯环空间位阻 (3)受首关效应影响,通常采用注射给药 (4)遇光易变质,故应密闭保存 阿片μ受体激动剂 代谢: N脱甲基,生成无作用的去甲基哌替啶,去甲基哌替啶体内消除很慢,易蓄积产生中枢毒性,引发癫痫,不用于慢性疼痛的治疗。 ③药物相互作用:在 单胺氧化酶(MAO)抑制剂停止使用14d以上时小心使用,否则会发生严重的药物相互作用。 枸橼酸芬太尼 镇痛效力强 , 成瘾性亦强。其镇痛作用出现较快 , 持续时间短。可用于麻醉前给药及诱导麻醉 , 在各种手术中作为辅助用药与全麻药合用。 阿芬太尼(新) 镇痛比吗啡强 瑞芬太尼(新) 作用比阿芬太尼强,起效快,维持时间短 4氨基酮类 又称为苯基丙胺类,无吗啡类药物通常有的哌啶环,是一种开链的高度柔性分子。 盐酸美沙酮 结构特点:3-庚酮结构,无哌啶环,开链高度柔性,手性 理化性质: 本品的C -6为手性碳,其左旋体镇痛活性大于右旋体。临床使用外消旋体。 羰基不能发生一般的羰基反应 虽为μ受体激动剂,但成瘾性发生较慢,作用时间长,戒断症状较轻,常用作海洛因等成瘾造成的 戒断症状治疗(戒毒药)。 副作用(新):可导致罕见的心脏Q-T间期延长和尖端扭转型室性心动过速。 代谢产物有镇痛活性 右丙氧芬 结构中含有两个手性中心, 右旋体 镇痛 左旋体 镇咳 用于解热镇痛复方制剂,有依赖性 二、其他合成镇痛药 盐酸布桂嗪(强痛定) 结构:哌嗪,苯丙烯,丁酰基 作用特点: 显效快,有成瘾 盐酸曲马多 2个手性碳 环己烷 苯环和二甲氨基甲基呈反式 (+)-曲马多主要抑制5-HT(5-羟色胺)重摄取,同时为弱μ受体激动剂; (-)-曲马多是去甲肾上腺素重摄取抑制剂(阻断疼痛的传导),(±)-曲马多的镇痛作用得益于两者的协同性和互补性作用。 活性代谢 三、镇痛药的构效关系和阿片受体 1.阿片受体(三点模型) 主要结合点为:① 一个负离子部位;② 一个适合芳环的平坦区;③ 一个与烃基链相适应的凹槽部位。 2.药效模型:苯基和烷基取代的哌啶环是共有的药效基团。 3.μ受体选择性激动剂构效关系 (1) 芳环和碱性叔胺氮原子是μ受体激动剂的必要结构部分,二者通过2个或3个碳原子的碳链相连接,在生理pH条件下,碱性叔胺氮原子质子化成正离子形式。 (2)芳环 3位酚羟基的存在使活性显著增强。氮原子上以甲基取代活性好,当N-取代基增大到3~5个碳原子时,如烯丙基(纳洛酮)、环丁基甲基时,由激动剂转变为拮抗剂。 (3) μ受体选择性激动剂的药效构象相同,其芳环以直立键与哌啶环相连。 看了上面的内容,再看下历年真题:
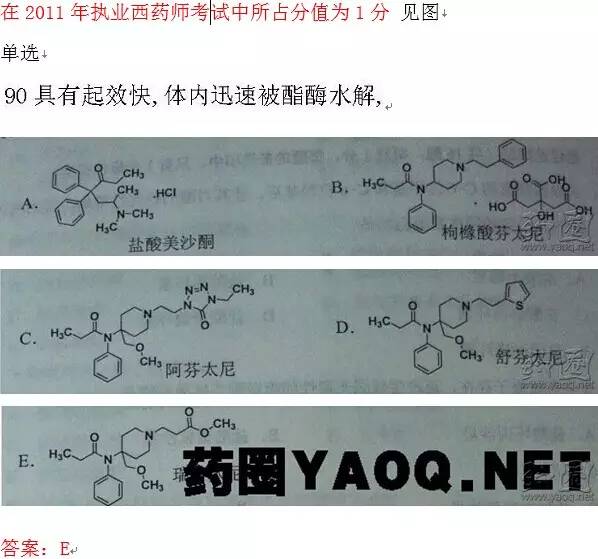

在2013年的考试中占2分(其中单选0分,配伍2分,多选0分),主要涉及的考题见下图: 
|