|
美国梅奥诊所 Limper博士近期发表综述,详细介绍了ICU患者常见肺部真菌感染的治疗。文章发表在2014年12月1日出版的chest杂志上。现全文翻译如下: 肺部真菌感染很常见, 但是肺部真菌感染的诊断和治疗在临床上都很困难。随着免疫功能低下患者人数的增加,真菌感染的发病率也在不断增长。因此需要提高对肺部真菌感染的认识,对诊断方法加以改进。新型抗真菌制剂已可以应对这一问题。这篇综述会详细介绍ICU患者常见肺部真菌感染的治疗。 传统和新型抗真菌制剂 过去十年中,有大量新型抗真菌制剂问世(表1)。当选择抗真菌制剂时,需权衡不同药物之间的优缺点以及患者疾病的临床表现和感染特点。一般情况下,制定抗真菌治疗方案时需首先明确致病菌。同时通过真菌感染的严重程度及患者感染的特点来制定个体化的治疗方案。 表1:目前抗真菌药物的作用机制 | | | | | | | | 抑制真菌C-14-α-去甲基酶介导的羊毛甾醇向麦角甾醇转化合成 | | | |
1、多烯类药物 (1)两性霉素B: 多烯类抗真菌药物的原型就是两性霉素B脱氧胆酸盐。尽管毒性较大,但是这类药物仍旧是重症真菌感染的首选,特别是那些危及生命的重症感染,包括:侵袭性曲霉菌病、部分全身念珠菌病和隐球菌病、重症组织胞浆菌病、芽生菌病、球孢子菌病和毛霉菌病。 多烯类抗真菌药物与真菌细胞膜中的麦角甾醇相结合,诱导细胞缺陷,增加细胞通透性,导致细胞死亡。 两性霉素B脱氧胆酸盐必须静脉使用。应用期间,需密切随访肌酐、尿素氮(BUN)、血钾、血镁、全血细胞计数(CBC)和肝功能。总的来说,使用两性霉素B时,需密切随访患者各项指标(每天一次或每两天一次)。两性霉素B导致的肾毒性可突然出现。 很多医生为了避免应用两性霉素B后出现发热和寒战,会在应用前给予患者使用解热镇痛剂、抗组胺类药物、抗吐剂或哌替啶。两性霉素B需缓慢静脉滴注,一般滴注时间要超过2-6小时;因为快速静滴会导致威胁生命的高钾血症和心律失常的出现。 当和其他肾毒性药物联用时(如:氨基糖苷类),肾毒性作用会增加。两性霉素B的肾毒性是剂量相关的。对于重症免疫缺陷患者、肾功能受损患者、使用其他肾毒性药物的患者、使用两性霉素B剂量≥1.0mg/kg/d的患者,强烈建议使用两性霉素脂质体来避免肾毒性的高发病率。肝毒性也会发生,但是比较罕见。 (2)两性霉素脂质体: 目前为止已有数种两性霉素脂质体制剂问世,包括:两性霉素B脂质体、两性霉素B脂质体复合物和两性霉素B胆固醇硫酸钠复合物。相比两性霉素B脱氧胆酸盐,这些脂质体制剂可以显著降低肾毒性。 在美国、加拿大和欧洲大部分地区,两性霉素B脂质体已经在很大程度上取代了两性霉素B的应用,特别是在免疫功能低下的患者中。但是在发展中国家,两性霉素B脱氧胆酸盐的应用正变得越来越多。目前几乎没有研究能证实,两性霉素脂质体的疗效要好于两性霉素B脱氧胆酸盐。 应进行平行对照研究来了解两性霉素B和两性霉素B脂质体的副作用。动物模型研究指出,相比两性霉素B脱氧胆酸盐,两性霉素脂质体制剂中枢神经系统(CNS)浓度更高。但是尚无人体试验能证实这一点。 2、三唑类抗真菌药物 唑类抗真菌药物具有口服活性,包括:伊曲康唑、氟康唑、伏立康唑和泊沙康唑。三唑类药物通过抑制真菌C-14-α-去甲基酶介导的羊毛甾醇向麦角甾醇转化合成来发挥作用。已有研究指出,唑类药物与人类细胞色素P450酶之间存在相互作用。 因此对于免疫抑制患者,唑类药物的应用是一个挑战,特别是对于同时接受多种药物治疗的患者,如:移植患者和艾滋病毒(HIV)感染患者。当唑类药物与环孢素、笨二氮卓类药物、他汀类药物和某些抗HIV药物同时应用时,会产生药物互相作用,导致细胞色素P450酶活性和代谢率的改变。 此外,所有唑类药物都会延长QTc间期,应用时必须特别注意;特别是当与其他可能导致QT间期延长的药物联用时。早期制剂,如:酮康唑,是咪唑类药物,对激素水平和肾上腺皮质功能会产生较明显的副作用,目前已被新型三唑类制剂所取代。 口服酮康唑会导致肾上腺副作用和严重肝毒性,随着毒性较低和作用更好的三唑类药物问世,酮康唑应该不再用于一线治疗。此外唑类药物是C类药物,不能用于孕妇。相反的是,两性霉素B是B类药物,可以用于孕妇;所以在重症感染时,首先考虑应用两性霉素B。 (1)伊曲康唑: 伊曲康唑有一个亲脂的尾端,可以增强抗真菌活性,如:曲霉菌株。伊曲康唑能有效治疗部分曲霉菌感染、粘膜念珠菌感染、组织胞浆菌病、芽生菌病和球孢子菌病。但是伊曲康唑与蛋白结合率极高,几乎无法渗透入脑脊液,因此不能用于治疗CNS感染。 伊曲康唑有口服胶囊和口服溶液两种制剂。口服制剂需要在有胃酸的环境中进行吸收,因此口服胶囊应与食物或酸性饮料同时服用。应避免在使用伊曲康唑时,同时应用抑酸剂和质子泵抑制剂。为了使伊曲康唑吸收更稳定,伊曲康唑口服液中含有环糊精。伊曲康唑口服液应空腹时服用。 当使用伊曲康唑时,需常规监测伊曲康唑血药浓度。对于肾功能受损的患者,不需要调整口服伊曲康唑剂量。伊曲康唑在肝脏进行代谢,对于严重肝功能受损患者应慎用。伊曲康唑的副作用较少,包括:外周水肿、皮疹、腹泻和恶心。严重的副作用发生更罕见,包括:充血性心力衰竭、Stevens-Johnson综合症和肝损伤。 和其他唑类药物一样,伊曲康唑与很多细胞色素P450代谢相关的药物同时服用时会产生相互作用。 (2)伏立康唑: 伏立康唑有静脉和口服制剂两种,目前广泛应用于治疗侵袭性曲霉菌病和其他真菌感染中。和大多数唑类药物一样,当与其他细胞色素P450代谢及通路(包括:CYP34A、CYP2C9和CYP3A4)相关药物联用时,需注意药物间的相互作用。对于肝硬化患者,伏立康唑应慎用。 静脉伏立康唑制剂中含有环糊精,因此肾功能受损患者应慎用;因为环糊精会在肾脏中累积。口服伏立康唑制剂中没有环糊精,必要时可以替代静脉制剂应用。对于轻中度肾功能受损患者,不需要调整伏立康唑剂量。如果必须要在肾功能受损患者中应用静脉伏立康唑,需密切监测患者血肌酐水平。 一般情况下,伏立康唑不应用于严重肝功能受损患者中;除非没有其他药物选择、综合评估后获益大于风险时,尚可应用。伏立康唑有光敏性,所以应用时应避免日光直射。随着伏立康唑越来越多的预防性应用于严重免疫缺陷患者中,出现了不少慢性光敏反应的病例。 应用伏立康唑后也有不少非黑色素瘤皮肤癌的报道。但是免疫抑制患者本身就有不少皮肤癌的危险因素。最近研究指出,应用伏立康唑并不是导致皮肤恶性肿瘤的唯一危险因素。尽管因此,临床医生仍需关注这类患者皮肤病变和恶性肿瘤(包括黑色素瘤)的情况。 伏立康唑的副作用还包括:恶心、呕吐、皮疹和肝功能异常。目前严重肝功能异常的副作用已很少见。应用伏立康唑后确实会出现外周水肿,但是相比伊曲康唑其发生率显著下降。大约1/3的患者会出现视觉异常。但这一并发症通常只持续数小时,然后逐渐消散;一般数天到数周后,可恢复正常。 伏立康唑药物代谢情况因人而异,因此需定期监测血药水平。 (3)泊沙康唑: 泊沙康唑可以作为侵袭性真菌感染的有效预防性用药,包括:免疫缺陷患者的曲霉菌病和播散性念珠菌病;也可有效治疗HIV患者的口咽念珠菌病以及对于伏立康唑和伊曲康唑耐药的重症口咽念珠菌感染。 对于重症免疫缺陷患者,泊沙康唑作为二线用药有效治疗该难治性曲霉菌感染及球孢子菌病。泊沙康唑也可有效治疗毛霉菌病。常见副作用包括:腹部不适和腹泻。严重毒性作用包括:偶发肝功能异常。泊沙康唑会达到吸收饱和,因此为了取得最佳吸收效果,需要有充分的膳食脂肪。 对于中重度肝功能或肾功能受损患者,不需要进行剂量调整。当对药物毒性进行临床监测时,需包括肝功能检测。泊沙康唑现在已有口服控释片问世,可以取代之前吸收较差的口服混悬液。此外,静脉制剂也已问世,这可以推动泊沙康唑在重症真菌感染患者中的应用。 (4)氟康唑: 氟康唑是一种低脂溶性药物,应用方便,能有效治疗白色念珠菌。氟康唑常用于预防和治疗粘膜念珠菌病和侵袭性念珠菌病,对球孢子菌病和隐球菌病也有效。对于肾功能不全的患者需调整剂量。当肌酐清除率 < 50mL/min时,氟康唑剂量需减少至50%。接受血液透析患者在血透后需要给予全量。 相比其他唑类抗真菌制剂,如:伊曲康唑、伏立康唑和泊沙康唑,氟康唑与其他药物间的相互作用是相对较少的,比伏立康唑还要少(伏立康唑是一个对P450和相关通路较弱的抑制剂)。副作用相对较少,但是也可以出现皮疹、皮肤瘙痒、头痛、恶心、呕吐和转氨酶水平的增高。 其他新兴唑类药物:针对新兴唑类抗真菌药物(如:雷夫康唑、艾莎康唑、阿巴康唑)的临床研究正在进行中。这些药物的临床有效性和适应症尚未完全确定。 3、棘白菌素类 这类药物通过抑制质膜上的β-1,3-D-葡聚糖合成酶、破坏真菌细胞壁来发挥作用。 (1)卡泊芬静: 卡泊芬静对白色念珠菌有杀菌作用,对曲霉菌有抑菌作用。卡泊芬静最初主要应用于治疗白色念珠菌感染。但卡泊芬静也可用于治疗中性粒细胞减少患者的发热,可作为侵袭性曲霉菌肺炎治疗中的一部分。 未经美国食品药物管理局(FDA)批准通过的适应症还包括:经验性应用于疑似侵袭性真菌感染患者中、预防性应用于重症免疫缺陷患者中。基础研究指出,卡泊芬静可有效治疗卡什肺孢子虫感染。但是目前尚无确切的临床研究能明确:棘白菌素是否可有效治疗卡什肺孢子虫肺炎患者。因此,棘白菌素不应作为卡什肺孢子虫感染的一线或单药治疗方案。 由于细胞壁黑化作用,所以隐球菌对卡泊芬静是天然耐药的。卡泊芬静有静脉制剂,在肝脏代谢,所以当肝功能受损时需调整剂量。当患者存在肝功能受损、怀孕、或同时使用环孢霉素时,需慎用卡泊芬静。 有趣的是,卡泊芬静和其他棘白菌素类药物不会影响细胞色素酶系统。但是当和环孢霉素、他克莫司、利福平和特定抗HIV药物联用时,药物间的相互作用仍会发生。其他副作用包括:肝酶升高、面部肿胀、头痛、皮肤瘙痒和恶心。过敏反应很少见。极个别患者会对所有棘白菌素类药物出现过敏。 (2)阿尼芬静: 阿尼芬静可用于治疗念珠菌血症、侵袭性念珠菌病和念珠菌性食道炎。阿尼芬静也能有效治疗曲霉菌感染。有时阿尼芬静还能经验性的用于疑似念珠菌血症的非中性粒细胞减少患者中。阿尼芬静耐受性较好。 常见副作用包括:低钾血症和腹泻。临床常见的不良反应包括:深静脉血栓形成(DVT)以及极罕见的肝毒性。 (3)米卡芬静: 米卡芬静可用于治疗念珠菌和曲霉菌感染;获准用于治疗侵袭性念珠菌病、预防性应用于接受造血干细胞移植患者以避免侵袭性念珠菌病的出现,预防性治疗念珠菌性食道炎。副作用包括:皮疹、腹部不适伴恶心、呕吐、腹泻和黄疸。注射部位可发生静脉炎。 目前所有3种批准上市的棘白菌素对念珠菌感染都应视为是同样有效的 肺部真菌感染的临床特点 真菌感染可发生在免疫功能正常和免疫功能抑制/缺陷个体中。临床医生需关注那些可能提示为真菌感染的临床体征,如:持续性肺部浸润,伴或不伴纵隔淋巴结肿大(表2)。部分患者也可表现为肺部和脾脏弥漫性钙化肉芽肿,特别是那些组织胞浆菌病患者。这些浸润病灶对常用抗生素治疗无效。 表2:提示真菌感染的相关因素 | | 明显中性粒细胞减少患者(中性粒细胞绝对计数 < 500/μL,病程 > 21天),血液系统恶性肿瘤患者,接受造血干细胞移植患者,接受实体器官患者,恶性肿瘤患者接受化疗 | 患者存在免疫抑制状态(慢性激素应用,新的免疫抑制剂应用,肾功能不全,COPD,糖尿病,肝硬化) | | | 相关皮肤病变(结节性红斑、麻疹样或毒性皮疹),关节炎,骨病变,CNS播散 |
免疫缺陷患者的真菌感染主要是由于念珠菌血流感染和侵袭性曲霉菌的组织感染,包括:侵袭性曲霉菌肺炎。但是其他真菌感染,包括:地方性真菌病(球孢子菌病、组织胞浆菌病和芽生菌病,取决于地理区域的不同)和卡什肺囊虫肺炎,也往往会出现在免疫缺陷患者中。 需引起重视的是,除了白色念珠菌以外,其他念珠菌病的感染发生率正在不断增加。更耐药的真菌感染发生率,包括:毛霉菌和丝孢菌感染,也在不断增加中。 地方性真菌病的治疗方法 地方性真菌病包括组织胞浆菌病、芽生菌病和球孢子菌病。这些真菌感染可发生在免疫功能正常和免疫功能低下/缺陷个体中。隐球菌肺炎和隐球菌脑膜炎也是常见的真菌感染。 地方性真菌病的有效诊断需要:明确不同感染的地区差异、临床特征、相关血清学检测、聚合酶链反应检测、支气管镜检查以及必要是的腰椎穿刺术。这些感染的临床诊断已在其他综述中详细介绍。地方性真菌病治疗方案取决于患者的免疫状态。 一般情况下,非重症真菌感染选用广谱唑类药物;重症感染首先选择两性霉素脂质体,待患者病情稳定后,选择长期使用广谱唑类药物。针对具体地方性真菌病和隐球菌病感染应制定个体化的临床治疗方案。 1、组织胞浆菌病和相关后遗症 荚膜组织胞浆菌可引起的感染包括:伴或不伴淋巴结肿大的孤立性肺结节、支气管结石症、纵隔肉芽肿和纤维化、有症状的或播散型肺组织胞浆菌病(包括:组织胞浆菌相关的急性呼吸窘迫综合征[ARDS]和慢性肺组织胞浆菌病)。 临床症状较轻、免疫功能正常的肺结节或孤立支气管结石症患者,通常不需要唑类药物的治疗。 有症状的或活动性组织胞浆菌病结节状浸润,伴或不伴明显淋巴结肿大患者,通常需使用伊曲康唑治疗同时预防后遗症的出现(如:纤维性纵隔炎),剂量为200mg bid,疗程3个月。但是,目前尚无研究可证实:抗真菌治疗可以降低纤维性纵隔炎的发生率。 纵隔肉芽肿伴随大量淋巴结肿大患者,若血清学或尿液抗原检测阳性,提示存在近期或活动性感染,可给予伊曲康唑治疗,剂量为200mg bid,首先治疗12周。若临床症状有所改善,可以继续治疗至12个月。 不幸的是,大多纤维性纵隔炎使用那个唑类药物治疗无效。抗纤维化药物和全身激素应用也不能有效治疗纤维性纵隔炎。纤维性纵隔炎可导致严重的血管或气道变形,需要植入血管内或支气管内支架,接受支气管成形术或进行其他外科手术干预。 支气管结石症是由于组织胞浆菌病感染淋巴结,淋巴结钙化所导致,可能会进入支气管腔内。当支气管结石症合并咯血或肺不张时,可行支气管镜检查评估病情,经支气管镜或外科手术行取石术。当进行支气管镜取石时,必须小心谨慎,避免大出血的发生。 轻中度有症状的肺组织胞浆菌病肺炎患者,一般首选伊曲康唑治疗,疗程12周。但是对于重症组织胞浆菌病患者,如果有危及生命的肺部感染伴严重气体交换异常(图1),应首选两性霉素脂质体治疗,直到临床症状有所改善。 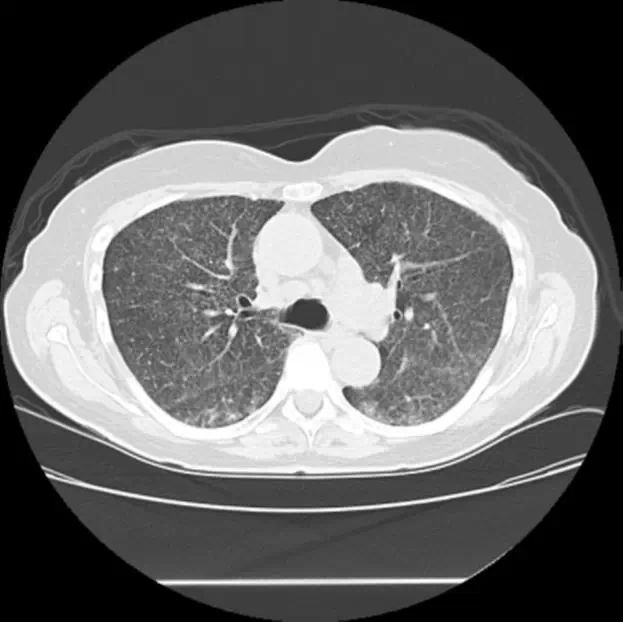
图1:进行性播散型组织胞浆菌病患者的CT影像。这是一名72岁有类风湿性关节炎的老年女性,正在接受阿达木单抗和氨甲喋呤免疫抑制治疗。这名妇女出现进行性的气体交换异常,CT显示有广泛播散的粟粒样结节浸润。支气管镜检查BAL中发现有组织胞浆菌,尿组织胞浆菌抗原阳性,从而得到确诊。 然后选用伊曲康唑作为维持治疗,剂量200mg bid,疗程至少为3个月。对于那些慢性肺组织胞浆菌病患者(常伴空洞),可选用伊曲康唑治疗,剂量200mg bid,疗程为12到24个月。 免疫缺陷/抑制的组织胞浆菌病患者治疗时往往需要调整药物的剂量。例如:免疫功能缺陷/抑制的、有症状的、轻中度组织胞浆菌病患者通常首选伊曲康唑治疗,开始3天剂量为200mg tid,随后调整为200mg bid,维持12个月。 重症免疫功能低下(如:AIDS)伴进行性播散型组织胞浆菌病患者,应首选静脉两性霉素脂质体,直到患者临床症状相对稳定。然后可使用口服伊曲康唑,200mg bid;直到有效免疫重建,CD 4+计数 > 200/μL。持续免疫缺陷/抑制患者需要终身维持治疗。 对于部分免疫缺陷/抑制患者伴重症肺组织胞浆菌病和弥漫性肺损伤,可以给予辅助激素治疗,建议用量为泼尼松40到60mg/d,持续1到2周,可使这些患者临床症状有所改善。 2、芽生菌病感染 皮炎芽生菌,是双相型真菌,好发于美国中部和东南部,会导致急性、亚急性和慢性肺部感染。到目前为止,芽生菌病相关的ARDS和重症弥漫性肺炎病例报道的数量很少。皮芽生菌感染更常见表现为非重症感染,如:大叶性肺炎、大面积实变病灶、肺结节和慢性纤维空洞性病变。 皮肤播散最常发生。有时也会累及骨关节、很少累及CNS。对于轻中度免疫缺陷/抑制患者,一般首选口服伊曲康唑治疗,200 mg bid,疗程为6个月。但是,对于骨关节芽生菌病患者,伊曲康唑疗程需延长至12个月。 对于重症肺芽生菌病患者,如:弥漫性肺损伤或全身重症病变,应首选静脉两性霉素B治疗,直到临床症状缓解。然后继续口服伊曲康唑6个月,200mg bid。体外实验和少量临床研究提示,也可选用伏立康唑治疗,200mg bid。激素辅助治疗对于部分重症芽生菌病ARDS患者有效。 免疫缺陷/抑制合并轻中度肺芽生菌病患者,若不伴CNS受累,可口服伊曲康唑 200mg bid,疗程至少在12个月以上。但是对于重症肺芽生菌病不伴CNS累及的患者,应首选两性霉素脂质体治疗,直到达到临床稳态。然后改用口服伊曲康唑治疗,疗程至少12个月。 AIDS患者需要终身持续口服伊曲康唑 200mg/d,或服用至免疫功能重建为止。 肺芽生菌病合并CNS感染患者,应首选两性霉素B脂质体治疗(5mg/kg/d),直到达到临床稳态。在停用静脉两性霉素B后,应继续使用伊曲康唑,疗程至少12个月。也可选用伏立康唑来替代伊曲康唑治疗,剂量为200mg bid。合并CNS感染的AIDS患者应终身口服伏立康唑 400mg/天,或服用至免疫功能恢复。 3、球孢子菌病 球孢子菌病是因为吸入含球孢子菌的尘埃而感染,好发于美国加利福尼亚州圣金华河谷、亚利桑那州中南部和墨西哥西北部。很多球孢子菌病感染症状轻微。部分感染可出现类似社区获得性肺炎的肺部症状。 急性肺球孢子菌病和细菌性社区获得性肺炎的不同点包括:一般抗菌治疗无效、同时合并肺门淋巴结肿大、外周血嗜酸性粒细胞增多、疲劳、盗汗、皮肤病变(部分患者可出现多形性红斑或结节性红斑)。急性原发性肺球孢子菌病经常是自限性的。 绝大多数免疫缺陷/抑制合并原发性肺球孢子菌病患者,如果没有全身播散的危险因素,不需要治疗。但是必须对每位患者全身播散危险因素进行仔细评估。这些危险因素在表3中做了详细讨论。 表3:球孢子菌病播散的危险因素 此外,某些疾病状态会导致重症肺部感染出现的风险增高,包括:慢性阻塞性肺部疾病(COPD)和其他结构性肺部疾病、肾功能衰竭和充血性心力衰竭。 免疫功能正常合并中重度肺球孢子菌病患者,治疗首选伏立康唑(400mg/d)或伊曲康唑(400mg/d),疗程至少为6个月;如果临床症状或影像学表现无明显改善,则治疗时间需进一步延长。泊沙康唑也能有效治疗球孢子菌感染,可用于治疗耐药病例。 只有球孢子菌相关肺结节患者,可首先观察1年,不需要抗真菌治疗。但是当合并重度免疫抑制状态(如:化疗、全身激素治疗、CD4计数 < 200/μL)时,可以给予应用伊曲康唑或伏立康唑。 治疗原发性肺球孢子菌病时不能忽视全身播散的风险(表3)。可给予伏立康唑(400mg/d)或伊曲康唑(400mg/d)。球孢子菌相关肺结节若合并全身播散危险因素、合并空洞型病变伴或不伴咯血时,可以使用伏立康唑或伊曲康唑治疗。 对于那些有症状的慢性肺结节或慢性肺空洞型球孢子菌病患者,病程超过3个月的,可给予唑类药物治疗,疗程需延长到12到18个月或更长,直到肺空洞或临床症状稳定。 弥漫性肺球孢子菌病合并弥漫性肺损伤和气体交换障碍患者,首选两性霉素B治疗。待临床症状改善后,改用伏立康唑(400mg/d)或者伊曲康唑(400mg/d)治疗,疗程至少为1年。免疫抑制/缺陷患者需要接受持续唑类药物治疗直到免疫功能恢复。 球孢子菌病可以从肺部播散至骨头、关节、皮肤、CNS等。对于不存在脑膜播散患者,可给予伏立康唑(400mg/d)或伊曲康唑(400mg/d)治疗,疗程至少为1年,直到临床稳定。对于骨关节球孢子菌病患者,首选伊曲康唑。 重症患者首选静脉两性霉素脂质体,待临床稳定后,改用伏立康唑(400mg/d)或伊曲康唑(400mg/d)治疗,疗程至少为1年。合并神经系统症状的原发性球孢子菌病患者,需要行腰椎穿刺术来了解是否存在球孢子菌性脑膜炎。 播散型球孢子菌病和脑膜炎患者,首选两性霉素脂质体,待临床稳定后,改用唑类药物治疗,如:伏立康唑(800-1000mg/d),唑类药物可能需要终身用药。因为如果停药的话,很容易造成复发。 曲霉菌病的治疗 肺曲霉菌病的治疗取决于医疗环境、免疫状态和疾病状态。当足分支菌定植在预先存在的肺空洞中形成曲霉肿时,往往存在出血倾向。可通过放射介入栓塞治疗大出血来挽救生命。外科手术治疗曲霉肿,并发症发生率和死亡率均较高。 但是,仍然有部分病例必须行外科手术切除。有时当患者存在免疫抑制/缺陷时,曲霉肿可以进展为慢性坏死性曲霉菌病。 侵袭性曲霉菌肺炎一般只发生在免疫缺陷/抑制患者中,通常是那些合并中性粒细胞减少、大量激素应用或接受细胞毒药物化疗患者。目前侵袭性曲霉菌肺炎的一线治疗是静脉使用伏立康唑:第一天6mg/kg q12h,第二天起4mg/kg q4h,直到临床改善。病情稳定后,可改用口服伏立康唑,200mg q12h,直到病灶消散。 或者也可以使用静脉两性霉素脂质体(3-5mg/kg/d),直到临床改善。继而选用口服伏立康唑 200mg q12h。只要有可能,在治疗期间应尽可能的改善患者免疫状态。 侵袭性肺曲霉菌病患者一线治疗失败的,可给予棘白菌素治疗,如:静脉卡泊芬静(第一天 70mg,第二天起50mg/d)。目前并不清楚棘白菌素联用伏立康唑能否改善疗效。 此外,口服泊沙康唑也可以用于一线治疗失败的患者。难治性、局灶性、侵袭性肺曲霉菌病患者积极治疗失败的,可考虑行外科手术切除治疗。 慢性坏死性曲霉菌病治疗需要根据疾病的严重程度和患者的免疫状态进行个体化的治疗。轻中度感染患者可以给予口服伏立康唑或伊曲康唑治疗,直到临床稳定。重症患者可以首选静脉伏立康唑或两性霉素脂质体治疗。根据疾病的严重程度、播散程度(局灶或播散)和对抗菌药物治疗的反应,部分患者可以考虑外科手术治疗。 结论 研究表明,真菌易感人群患者的人数正在不断增加。对于免疫缺陷/抑制患者,需考虑侵袭性真菌感染的可能性。合理的选择诊断性测试、快速对症治疗可以最大程度的改善临床转归。
|